WOAH und Nationales Referenzlabor für Bovine Herpesvirus Typ 1-Infektion (BHV-1)
Das Bovine Herpesvirus 1 (BHV-1) ist auch bekannt als IBR- oder IPV-Virus und Verursacher der entsprechenden Krankheitsbilder (Infektiöse Bovine Rhinotracheitis und Infektiöse Vulvovaginitis). Aufgrund seiner wirtschaftlichen Bedeutung sind in einigen europäischen Ländern große Anstrengungen unternommen worden, diese Erkrankung in der Rinderpopulation zu tilgen. Länder wie Dänemark, Österreich, Südtirol oder die Schweiz besitzen bereits seit Jahren den Status „BHV-1 frei“ entsprechend des Artikels 10 der EU-Richtlinie 64/432/EWG. Seit dem 25. November 1997 wird die Bekämpfung der BHV-1-Infektion auch in Deutschland in Form der BHV-1-Verordnung gesetzlich gemaßregelt. BHV‑1 wurde in der Bundesrepublik damit zu einer der anzeigepflichtigen Tierseuchen. Tragender Bestandteil der BHV‑1-Verordnung ist die Vakzinierung mit gE-Deletionsvakzinen und die gezielte Differenzierung von geimpften und Feldvirus-infizierten Rindern durch den Nachweis von gE-spezifischen Antikörpern. Vakzinen dieser Art werden in der EU seit neuestem als DIVA-Impfstoffe (Differentiating Vaccinated from Infected Animals) bezeichnet. Die Impfung mit diesen DIVA-Vakzinen soll dabei Feldvirus aus den verseuchten Regionen und Beständen verdrängen, ohne die Diagnostik zu beeinträchtigen.
Doch eben diese Kombination aus DIVA-Vakzine und Markerdiagnostik eröffnete ein neues Problemfeld für die BHV-1-Serologie. Um diesen veränderten Herausforderungen gerecht zu werden, wurde am 03.01.2000 das Nationale Referenzlabor für BHV-1 ins Leben gerufen, das am Institut für Virusdiagnostik des FLI auf der Insel Riems angesiedelt ist. Die Bundesrepublik gehört damit zu den ersten EU-Staaten mit einer solchen Referenzstelle. Ein gemeinsames EU-Referenzzentrum existiert bisher nicht. Das NRL für BHV-1 ist seit einigen Jahren als Referenzlabor der Welttiergesundheitsorganisation (WOAH) anerkannt und dient daher nicht nur als Ansprechpartner für Behörden des Bundes und der Länder, sondern leistet auch bei internationalen Anfragen Unterstützung. Zudem betreibt das BHV-1-Referenzlabor Forschung auf dem Gebiet der Diagnostik, Immunprophylaxe und Pathogenese. Die derzeitige Entwicklungsarbeit konzentriert sich auf die gE-Markerdiagnostik und vergleichende Diagnostik bezüglich nah verwandter Herpesviren. Aber auch die markerunabhängige BHV-1-Diagnostik vom Neutralisationstest bis zum indirekten BHV‑1-Antikörper-ELISA wurde in den letzten Jahren durch das NRL optimiert und validiert. Das NRL BHV‑1 ist entsprechend ISO17025 akkreditiert.
Im Moment ist die Bekämpfung der BHV-1-Infektion in Deutschland schon sehr weit fortgeschritten. Als erste BHV-1-freie Regionen wurden die Oberpfalz und Oberfranken von der EU-Kommission nach Artikel 10 der Richtlinie 64/432/EWG anerkannt. Nicht nur in Bayern ist der Anteil an sogenannten „Reagenten“ nur noch sehr gering, auch in den Bundesländern mit gezielten Impfprogrammen (z. B. Sachsen-Anhalt) sind kaum mehr gE-positive Bestände zu verzeichnen. Im Jahr 2008 waren 85,1% aller Milchvieh und Mutterkuhhaltungen als BHV-1- oder BHV-1-gE-frei eingestuft worden.
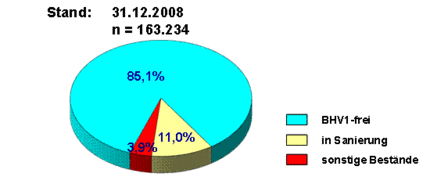
Deutschland befindet sich damit auf einem guten Weg in Richtung BHV-1-Freiheit und in naher Zukunft ist damit zu rechnen, dass weitere Gebiete in die Anerkennung aufgenommen werden.
- direkter Ansprechpartner für Bundes- und Länderbehörden zu Fragen der BHV-1-Bekämpfung
- Antigen- bzw. Genomnachweis in Untersuchungsmaterial
- BHV-1-Antikörpernachweis zur Abklärung unklarer Ergebnisse
- Bereithaltung von BHV-1-Virusstämmen, Referenzseren und BHV-1-spezifischen monoklonalen Antikörpern
- Überprüfung, Standardisierung und Weiterentwicklung von BHV-1-spezifischen Testverfahren
- Durchführung von Qualifizierungsmaßnahmen z. B. für Mitarbeiter der Untersuchungsämter
- Durchführung nationaler und internationaler Ringvergleichstests
- Teilnahme an internationalen und WOAH-Ringtests
- Beteiligung an Arbeitsgruppen und Forschungsprojekten der Europäischen Union
- Forschungsarbeit zur Weiterentwicklung und Standardisierung der BHV-1 Diagnostik sowie zu Fragen der Pathogenese oder Immunisierung
- Zellkultureller Virusnachweis (Virusisolierung)
- Genomnachweis mittels real-time PCR und PCR
- Multiplex real-time PCR zur Differenzierung von Feld- und Impfvirus
- Stammcharakterisierung durch Restriktionsenzymfragmentlängen-Polymorphismus (RFLP)-Analyse
differenzierende Neutralisations-und Plaquereduktionstests - Antikörpernachweis mittels Neutralisationstest und ELISA: differenzierende Antikörper-Analysen durch gB-blocking ELISAs, indirekte ELISAs und gE-blocking-ELISAs
- Panel von mehr als 200 BHV-1-Referenzseren
- Deutsche BHV-1-Referenzseren R1 (positiv), R2 (schwach positiv), R3 (sehr schwach positiv) sowie R31 und R32 (negativ)
- Deutsche Referenzmilchproben R26 (positiv) , R27 (schwach positiv) , R28 (positiv), R29 (schwach positiv), R30 (negativ)
- Verschiedene BHV-1-Referenzstämme
- Sammlung verwandter Herpesviren (BuHV-1, BoHV-5, CvHV-1, CvHV-2, CpHV-1)
- WOAH-gelistete Krankheit
- Besondere Garantien möglich gemäß EU-Richtlinie 64/432/EWG
- TierSeuchAnzV vom 03.11.2004, zuletzt geändert am 18.12.2009
- BHV1-VO vom 20.12.2005

